
一种快速制造出微纹理PS表面,以减少细胞粘附。
Introduction
细胞-基质粘附是一个关键的细胞过程,在这一过程中,粘附的细胞与其周围环境形成连接。细胞粘附信号调控着包括细胞生长和增殖、分化、迁移、组织稳态、肿瘤发生和伤口愈合的广泛的细胞过程。细胞-基质粘附受表面特性(包括表面能、化学性质、硬度和质地)控制。在体外培养细胞时,如大多数涉及癌细胞的生物医学研究,粘附的细胞必须首先附着在培养容器的表面,然后从表面脱离,以便传代或使用细胞。在这里作者研究了表面纹理如何影响细胞的粘附和分离。
Cell Adhesion Effects and In Vitro Cell Detachment
传统上,二维细胞培养几乎完全使用聚苯乙烯(PS)表面。当细胞外受体与PS基底接触时,会发生下游信号级联以启动粘附。细胞可能会表达粘附分子和蛋白质,如局灶粘附激酶、胶原、纤连蛋白和粘附素。因此,要使粘附的细胞培养物传代,就必须将这些蛋白质从其基底上裂解,以便使细胞从细胞培养物表面脱离。目前的细胞分离策略主要依赖酶解方法,这种方法会损害细胞活力,同时产生大量废液。
最常用的试剂是胰蛋白酶、Accutase和TryplE。对于所有类型的细胞,在高通量细胞培养过程中,胰蛋白酶处理都非常耗时,会产生大量液体和消耗性废品(如用于清洗细胞的缓冲液、胰蛋白酶和灭活胰蛋白酶的血清)。原代细胞培养物特别容易对细胞表面受体和其他蛋白质级特征造成损伤,从而限制了蛋白质组分析的保真度和准确性。虽然存在非酶类机械细胞分离策略,如细胞刮取,但这些方法对于蛋白质组分析来说同样过于苛刻,会导致蛋白质结构受损。因此,需要一种温和的、干扰最小的细胞分离策略,适合常规体外细胞培养应用和下游实验分析。
Non-Enzymatic Methods of Cell Detachment
非酶法细胞分离策略可避免胰蛋白酶化过程导致的基因突变,从而有利于原代细胞培养。胰蛋白酶在亚培养过程中对细胞造成的损伤会导致细胞存活率下降,体外培养的细胞与野生型细胞相比会发生显著的突变。然而,这种方法不适于传代,尤其是在高通量工作流程中。其他热响应技术已被证明工作速度更快,但随着时间的推移,细胞的生长和增殖速度大大降低。因此,显然需要能降低细胞粘附强度的表面,以实现更快、更简单的细胞分离方法,而无需使用胰蛋白酶。这种表面还可用于自动化高通量细胞培养过程的实施。
Microtextured Surfaces for Cell Culture
微纹理表面可用于创建减少细胞粘附的被动表面。 这种策略对于研究材料几何形状对细胞迁移、形态、排列、分化和功能的影响很有价值,尤其是在生物材料领域。在某些情况下,纹理表面可用于改善植入物等的粘附性,但其在细胞培养等情况下用于调节粘附和分离的作用还很有限。以前对纳米和微纹理表面细胞粘附性的研究主要显示不同表面上生长的细胞数量的差异,而不是直接测量粘附强度。这些研究表明,纳米级粗糙度可增加细胞粘附力,而某些微尺度纹理可阻止细胞粘附或导致粘附在表面上的细胞数量减少。
以往许多评估微纹理表面细胞生长的研究使用的材料与传统细胞培养材料不同。经常报道的材料包括钛合金、硅树脂和聚二甲基硅氧烷(PDMS)。与PS不同的是,这些基底已被证明具有某些功能性生物活性。例如,钛已被证明可影响细胞增殖、分化和存活率,具体取决于细胞系和额外的表面修饰。使用PDMS是因为它易于成型,但由于材料的疏水复原性,它是一种不理想的细胞培养表面。由于干扰预期的体外细胞生物学和材料生物相容性差,限制了纹理表面在细胞培养研究中的广泛应用和对惰性几何形状的进一步探索。目前,我们对生化惰性表面上的微纹理几何形状如何进行工程设计、扰乱细胞行为并用于下游细胞培养应用的理解还存在差距。
Fabrication of Microtextured Polystyrene
虽然PS仍是最广泛使用的细胞培养材料,但对PS进行纹理处理的方法并不容易获得。以往在PS中生成微纹理的方法包括注塑成型,这种方法可以扩展,但有与细胞大小相关的特征尺寸限制,而且生产耗时且成本高昂。压痕或热压印等技术可以对设计进行更多的反复加工,但需要昂贵的设备,可能会对材料造成损坏和应力。在PS上直接使用反应离子蚀刻等传统光刻技术具有挑战性,也很难产生微尺度设计。之前的研究人员已经创造了一种光固化PS溶液,但这种技术依赖于复杂的化学合成,而且聚合物对光的敏感性使得该工艺难以规模化。其他研究小组已经研究了基于PDMS的PS微成型,但还没有将其用于在传统的PS孔板内生成用于细胞培养的微混合物、 作者的技术以Wang等人的方法为基础,使用PDMS印章将微纹理注入现成的细胞培养皿中,同时使用的溶剂量更少,与以前的方法相比,更容易进行高通量细胞培养,同时保留了以高精度和可重复性创建微米尺寸特征的能力。这种制造方法可将传统光刻技术产生的任何设计转化为成型PS的印章,从而轻松制造出具有任何所需微观纹理设计的表面。这种方法的另一个好处是,微纹理设计可以专门针对任何细胞类型进行定制。
在此,作者提出了一种新方法,用于精确设计和制造定制的微结构PS表面,以控制细胞粘附,从而促进细胞温和地脱离。作者评估了在不同密度(间距和直径均为1:1)的PS表面上成型的圆柱形柱子,并将其用作细胞培养表面。通过这些柱子表面,可以完全根据表面形态来调节细胞与表面的粘附程度。通过使用与细胞大小相当的PS微型柱,能在降低细胞与表面的粘附强度之间进行优化,同时保持正常表面的细胞生长特性。为了确保微混合物不会对细胞生长造成影响,作者在两种特性良好的细胞系MG-63(骨肉瘤细胞系)和LNCaP(前列腺癌细胞系)中评估了细胞活力、增殖和凋亡情况。此外,作者还进行了细胞图像分析以量化细胞形态变化,并开发了一种基于微流体的方法来测量细胞对这些表面的粘附水平。结果表明,这些微纹理表面可在减少表面接触的情况下实现细胞粘附,从而使细胞更容易分离。这种表面可为开发基于较低细胞分离力的流体或其他活性细胞分离方法提供信息,而且不需要使用胰蛋白酶。
Fabrication of Microtextured Polystyrene Surfaces
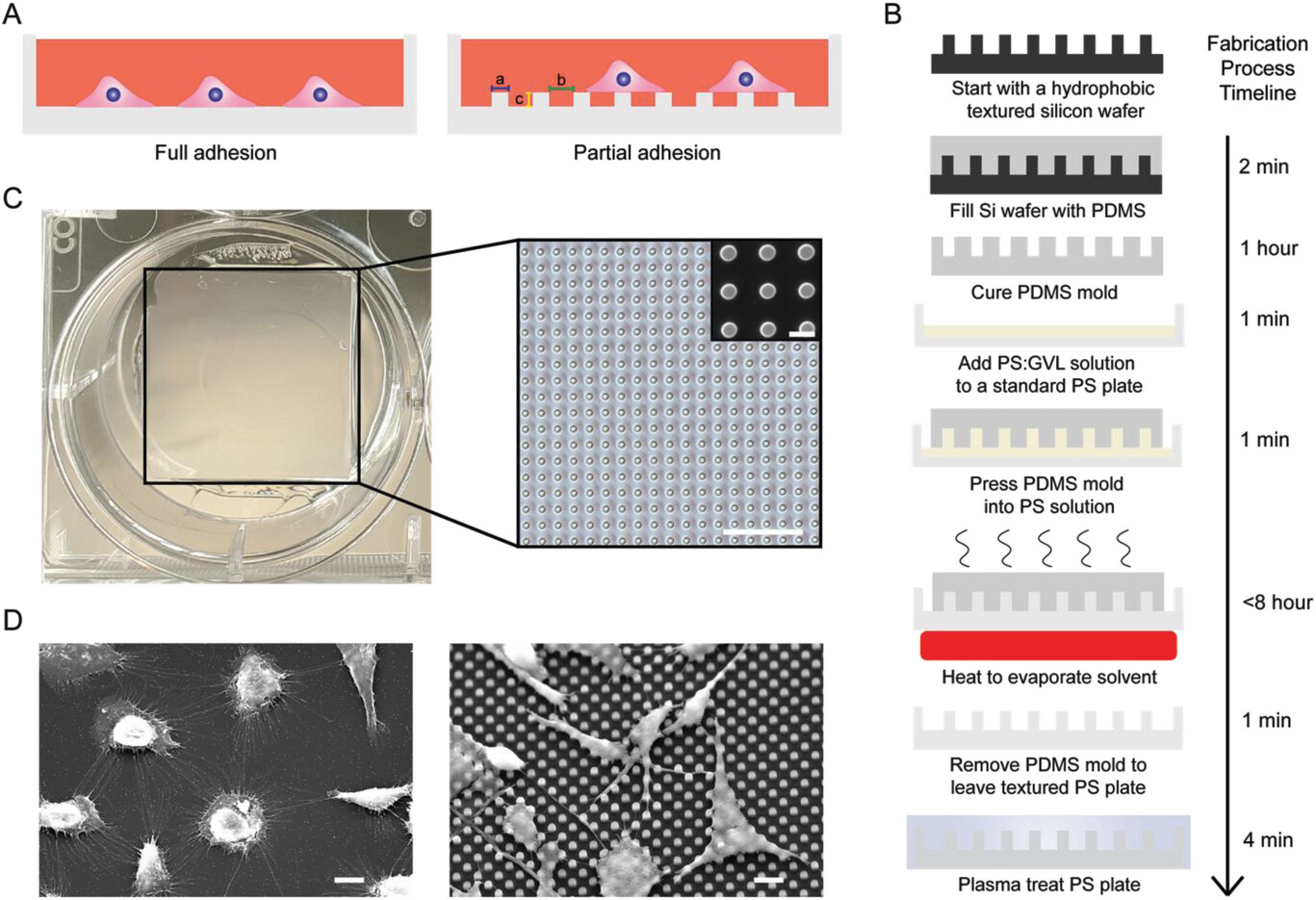
- (A)示意图显示微观纹理如何通过减少细胞与表面接触面积来减少细胞与表面粘附的概念。
- (B)示意图显示微纹理制造过程,包括每个步骤所需的时间。
- (C)具有微图案表面的6孔细胞培养板的图像、5 µm微柱表面在10倍放大倍率下的光学图像以及5 µm微柱表面的SEM图像。
- (D)在平坦PS表面(左图)和2.5 µm柱表面(右图)上生长的MG-63细胞在1000倍放大倍数和30°倾斜下的SEM图像。
GVL:γ-戊内酯,一种溶剂。
Impact of Microtexture on Doubling Time and Viability

- (A)LNCaP和MG-63细胞在PS表面培养时的白光图像,图中显示了在不同的柱尺寸中,低(上图,10×)和高(下图,5×)接种密度下的细胞增殖情况。
- (B)在微纹理PS上培养的细胞系倍增时间没有明显变化。
- (C)与标准的平整PS表面相比,在微纹理表面培养4 d后,细胞仍能保持较高的存活率(>95%)。
Molecular Level Evaluation of Cell Turnover

- (A)荧光成像(20×)显示染色固定和通透的细胞,以观察细胞的细胞骨架、细胞核和Ki67表达(检测静止G0期以外的细胞)。
- (B)在微纹理表面或标准平整PS组织培养表面培养48 h的细胞进行的基于流式细胞仪的EdU检测(检测S期细胞)结果。
- (C)Ki67 检测(i)和 EdU 流式检测(ii)的增殖测量结果。在蛋白质或DNA水平上进行的定量分析显示,在不同尺寸的微纹理表面上培养的MG-63或LNCaP细胞的细胞增殖与在平坦的PS表面上培养的细胞增殖相比没有显著差异。在所有条件下,细胞一般都能保持85%-90%+的增殖率。
- (D)培养7 d后,用Incucyte S3成像系统通过Cytotox Green染色法测量的总死细胞面积变化百分比。 细胞增殖和细胞死亡检测的这些一致结果表明:与平整的PS表面相比,微纹理PS表面不会影响细胞周期和倍增时间,因此可能适合常规细胞培养应用。
Impact of Microtexture on Cell Morphology

- (A-C)柱面和平面对照表面上每个细胞的特性分析:(A)细胞总面积;(B)细胞圆度(细胞面积与周长之比);(C)细胞长度与细胞面积。与平面表面相比,微柱表面的细胞面积要小得多;同样,微柱表面上的细胞更加细长。
- (D)如何计算每个细胞的柱子数量示意图。
- (E-F)每个柱面的细胞与表面接触分析。较小的柱子每个细胞的柱子数量较多。10 μm柱表面的比率最小,平均为0.5,表明生长在微柱表面的细胞的粘附强度可能只有生长在平面对照表面的细胞的一半。
Measurement of Cell Adhesion Strength

- (A)示意图显示如何将细胞装入微流控芯片,然后如何对细胞施加剪切力。
- (B)在微流控芯片内生长的细胞在施加剪切力之前和施加剪切力90 s后的图像。
- (C)施加1.5 nN剪切力90 s内各表面粘附细胞面积的延时图。
- (D)施加1.5 nN剪切力90 s后仍粘附的细胞百分比。平整表面的粘附力最强,剪切90 s后平均有10.5%的细胞脱离。从统计学角度看,柱面的粘附力明显较弱,2.5、5 和10 μm表面在90 s后的平均分离率分别为58.6%、45.1%和77.7%。这些结果验证了与平整的对照表面相比,生长在微柱表面的细胞具有较低的粘附强度。
Discussion
- 研究表明,在微纹理PS表面上生长的人类癌细胞,其倍增时间、增殖能力、细胞更替率和存活率在统计学上没有明显偏差。MG-63和LNCaP细胞系的群体倍增时间分别约为30 h和50 h。根据台盼蓝法测定的传代后存活率,这两种细胞系在所有表面上的存活率都保持在95%以上。同样,通过抗Ki67染色和EdU染色测定,MG-63(85-95%+)和 LNCaP(80-90%+)的增殖能力也达到了预期的高水平。两种增殖指数的结果一致,而且在所有培养细胞的表面上,数值都保持不变。培养一周后,通过荧光标记死细胞面积变化百分比测量的细胞更替率显示,在所有表面上,MG-63细胞和LNCaP细胞的变化率一致,分别为≈40%和≈20%。这些结果的一致性表明,微纹理表面可用于标准实验室环境中的人类癌细胞培养。不过,对表面特性和环境刺激更敏感的细胞类型,如干细胞,可能会对这些微纹理表面做出不同的反应。因此,未来的研究将需要调查这些微纹理对干细胞培养中细胞分化的影响。
- 在微纹理PS表面培养的MG-63细胞形态发生了显著变化,并进行了量化。与平整的对照表面相比,在微柱表面上培养的细胞,无论柱的尺寸如何,细胞群体面积平均减少了约两倍,圆度减少了两倍。这些细胞还表现出明显的拉长表型,在微纹理表面上达到相同细胞面积所需的时间几乎是在微纹理表面上的两倍。总体而言,细胞接触面积与柱子表面积的比率因柱子尺寸的不同而略有差异,10 μm×10 μm的比率最低,为≈0.5,其次是2.5 μm×2.5 μm的比率≈0.65,最后是5 μm×5 μm的比率≈0.7。这些差异没有统计学意义。不过,与在平整的对照表面(接触面积比=1)上培养的细胞相比,MG-63细胞的表面接触面积减少了30-50%。根据作者对细胞生长影响的研究结果,观察到的细胞形状扰动不太可能对体外群体的整体生长产生负面影响。部分原因可能是癌细胞具有众所周知的机械可塑性和柔软性,从而使其具有物理延展性,并能适应这种环境。
- 目前有许多技术可用于探测单细胞附着以及细胞群的粘附强度,但每种技术都有其局限性。单细胞技术,如原子力显微镜、牵引力显微镜和微量移液管操作测定,通常通量较低,并依赖于复杂的计算来确定粘附力。细胞群研究通常依靠剪切力去除细胞,这同样耗费时间,而且只适用于粘附力弱的细胞,灵敏度通常比单细胞测量低得多。通过这一过程可以比较细胞在不同表面形态下的相对粘附强度。细胞粘附的柱子数量与细胞的粘附强度相对应,粘附点越少,说明细胞对表面的附着力越弱。因此可以利用这一信息识别出既能使细胞附着又能正常生长,但表面接触面积比平面小的表面形态。
- 在这项研究中,作者保持了总有效表面积的恒定,没有发现因柱尺寸变化而产生的显著差异。这表明,有效表面积在决定细胞粘附力方面的作用比柱尺寸和间距更重要。因此,作者预计有效表面积越小,如柱间距越大,细胞与表面的粘附强度就越低,并认为这是一个值得未来研究的方向。然后,我们使用基于剪切力的装置直接测量细胞与每个表面的相对粘附力。剪切力数据与基于图像的计算结果非常吻合,接触面积越小,粘附强度越低。通过在每个表面施加相同时间的等效剪切力,我们可以比较细胞对每个表面的相对粘附强度。有趣的是,作者发现虽然微柱表面的柱密度不同,但细胞的粘附强度却保持在同一水平。这可能表明,微结构的可触及表面积或微结构之间的间距是调节细胞与微结构表面粘附强度的关键几何参数,而不是实际的表面形态。不过,要明确确定微纹理表面上细胞-表面粘附强度的调节特性,还需要进一步的研究。
- 能使细胞高度生长和增殖但粘附强度较低的表面在很多情况下都极具价值。通常,疏水表面或润滑剂浸渍表面(LIS)等低粘附表面的设计目的是防止细胞粘附。这类表面可用于防止生物膜或防止植入物堆积等应用。该表面可用于细胞培养,同时还能通过机械、非酶方法使细胞更容易分离。这对原代细胞培养尤其有帮助,因为在原代细胞培养中,基于胰蛋白酶的分离会对细胞活力造成伤害。微纹理还可用于培养皮肤移植或其他组织,使这些组织更容易从其生长的表面机械地剥离,从而减少剥离过程中对组织的损伤。此外,微纹理还可用于模拟人体组织微环境,使细胞与基质的粘附强度符合生理条件。
Conclusion
- 报告了一种新颖的设计工艺,能快速制造出微纹理PS表面,并证明了这些表面的生物相容性。在这项研究中,研究了具有相同有效后表面积的PS微柱图案如何影响细胞形态、粘附性、增殖、死亡率、倍增时间和存活率。虽然观察到了细胞形态和粘附性的变化,但这些变化对测量的生长参数并无显著影响。证明这些表面可用于长期、连续的细胞培养,适用于已建立的人类癌细胞系,如MG63和LnCAP细胞。不过,由于观察到的形态变化以及与正常细胞相比癌细胞硬度的降低,还需要进一步的工作来证明这些观察结果是否适用于正常细胞系、原代细胞或干细胞。
- 这些微纹理表面还可用于进一步调节细胞表面的粘附力。未来的研究可以探讨改变微纹理表面的有效表面积如何影响细胞的粘附强度,并研究细胞大小和形状的形态变化是否驱动了细胞粘附的这些变化。这些发现还能为低粘附表面的设计提供参考,从而提高现有细胞分离技术的速度和效果,甚至实现无需胰蛋白酶或其他酶的快速细胞分离方法。
Reference
McCue C, Atari A, Parks S, et al. Reducing Cancer Cell Adhesion using Microtextured Surfaces[J]. Small, 2023, 2302401.



